1966年,中国医学科学院血液学研究所发现,成药当归芦荟丸对慢性粒细胞白血病(CML)有一定的治疗效果,随后经过8次试方,终于在1974年确定了当归芦荟丸中的主要药味为青黛,其中所含的靛玉红是治疗CML的有效成分[1]。
此后,多项体内外试验表明,靛玉红以及衍生物对乳腺癌、肺癌、神经母细胞瘤等多种肿瘤均有抑制作用。尽管如今当归芦荟丸已不再用来治疗CML,但从中挖掘出的靛玉红还是引起了国内外学者们的广泛关注[2]。
哈佛大学医学院的Sean E. Lawler就是其中之一。
2011年,Sean E. Lawler团队在Cancer Research上发表的一项研究发现,靛玉红及其衍生物6'-溴靛玉红-3'-丙酮肟(BiA)对小鼠胶质母细胞瘤(GBM)有一定抑制作用,但其背后的原因并未找到,此外,由于BiA溶解性差,临床开发也一直受限[3]。
不过Sean E. Lawler并未放弃,历时多年,终于在近日发布了有关BiA的最新研究成果。Sean E. Lawler团队发现,BiA可以抑制GBM肿瘤微环境中与免疫逃逸密切相关的关键酶IDO1(吲哚胺2,3-双加氧酶)的表达,提高T细胞对GBM的杀伤力。
研究团队还用了一个搭载BiA的纳米颗粒配方—PPRX-1701,解决了BiA生物利用率低的问题,静脉注射PPRX-1701可阻断小鼠GBM模型肿瘤生长,提高小鼠的存活率。研究发表在Cell Reports Medicine上[4]。

论文首页截图
GBM是一种常见的中枢神经系统恶性肿瘤,也是世界上最难治疗的癌症之一,目前GBM疾病进程快,患者预后不理想,即便是经过标准治疗(术后同步放、化疗),GBM的中位生存期也不过15个月左右。
近年来,免疫治疗已被用在癌症的各个领域,但对于GBM而言,却用处不大。这可能是因为GBM的免疫抑制性肿瘤微环境导致的。简单来说,GBM细胞会通过合成免疫抑制细胞因子(如IDO1和PD-L1),给自己构建一个有利于自身发展的环境。
前面我们也说过,研究团队在小鼠模型中观察到靛玉红衍生物BiA对GBM生长有抑制作用,但至于怎么影响的,是不是通过改变GBM肿瘤微环境实现的,还不清楚。
为了解开这个疑惑,研究先观察了BiO(另一个靛玉红衍生物,与BiA结构相似)对GBM细胞的影响。转录组学分析显示,BiO对GBM细胞的基因表达产生了广泛的影响,共有1625个基因表达发生了显著改变,28个与免疫调节功能有关的基因表达下调,这其中就包括IDO1。
Figure1 28个与免疫调节功能有关的基因
接下来,研究团队在体外用IFNγ诱导GBM细胞系高表达IDO1,再加入BiA处理。结果发现,IDO1受抑制的程度会随着BiA浓度的增加而增加,当加入1μM BiA时,IDO1被完全抑制。此外,在体外共培养实验中,与不处理和单独活化T细胞相比,加入BiA后可显著增强T细胞对三种不同GBM干细胞系的杀伤力,肿瘤体积也明显缩小(p<0.005)。鉴于IDO1会抑制T细胞的免疫应答,所以研究团队认为,BiA可能通过下调包括IDO1在内的免疫抑制基因,提高了T细胞对GBM的杀伤力。
至此,困扰Sean E. Lawler的第一个问题解决了,那么接下来就要解决BiA利用率低的问题了。
为了增加BiA的溶解性,研究团队不断改进配方,开发出了BiA纳米颗粒配方—PPRX-1701,该配方由BiA亚微米颗粒组成,外部搭载生物可降解的聚乳酸-羟基乙酸共聚物(PLGA),可实现静脉注射给药,且相对BiA,PPRX-1701表面积更大,溶解性大幅改善。
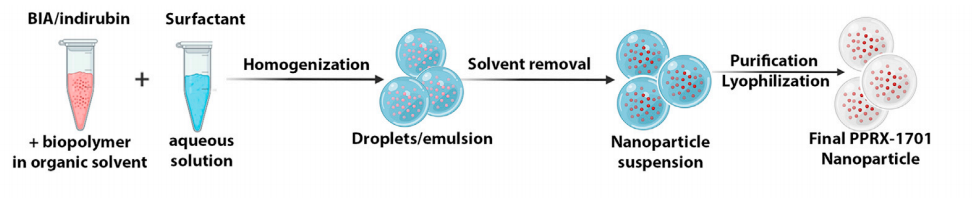
Figure2 PPRX-1701配方示意图
为了测试PPRX-1701是否能在体内发挥作用,研究团队向GBM小鼠尾部静脉注射了10 mg/kg PPRX-1701(高剂量BiA),利用topflash荧光素酶报告检测PPRX-1701的疗效。通过观察生物发光信号,研究团队发现,在注射1小时后,PPRX-1701中的BiA被成功地递送到了颅内肿瘤区域。
当研究团队对治疗后不同时间点的PPRX-1701组织/血浆比值,进行药代动力学评估后发现,在注射后的5个小时内,仍可在肿瘤组织中检测到PPRX-1701。这说明,静脉注射PPRX-1701可将有效浓度的BiA精准递送到GBM细胞周围。
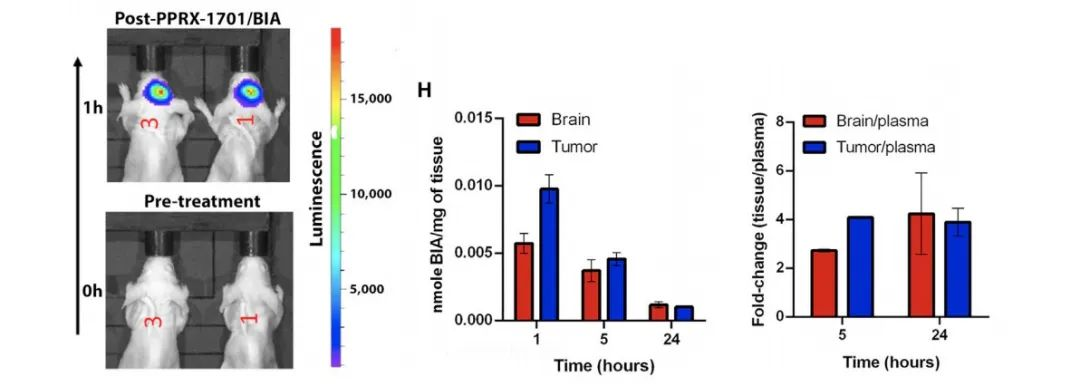
Figure3 PPRX-1701可有效到达小鼠脑肿瘤中
既然PPRX-1701可以在体内发挥作用,那么它是否也能减缓肿瘤进展呢?
为了回答这一问题,研究团队观察了PPRX-1701给药对免疫敏感GL261和免疫耐药CT-2A小鼠GBM模型生存期的影响。结果显示,在GL261小鼠模型中,与对照组(注射空白纳米颗粒)相比,接受PPRX-1701治疗(每周3次,共6剂,每剂20 mg/kg)的小鼠中位生存期更长(30天 vs. 42天),肿瘤体积更小(100 mm3 vs. 50 mm3)。在CT-2A小鼠模型中,PPRX-1701治疗也明显延长了小鼠的生存期,只不过与对照组相比,差异较小。
以上结果说明PPRX-1701可阻断小鼠GBM模型肿瘤生长,提高小鼠的存活率。
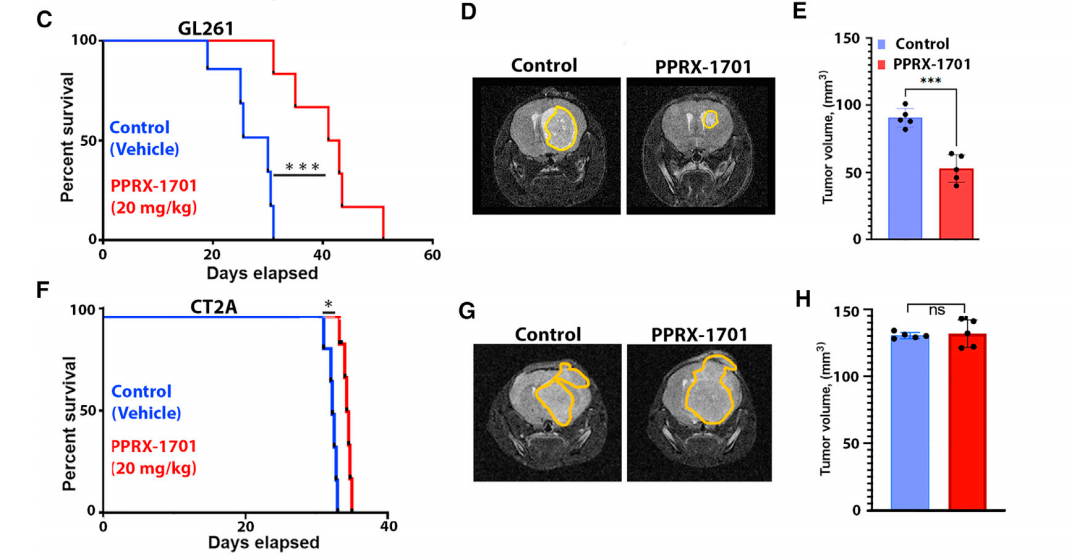
Figure4 PPRX-1701对肿瘤进展的影响
不过这些都是在年轻小鼠中进行的,由于GBM多见于65岁以上的老年人群,所以研究团队又在7个月龄的老年小鼠中重复上述实验,结果发现,PPRX-1701在老年小鼠中仍然有效。
组织病理学免疫荧光和qRT-PCR分析显示,在GL261小鼠模型中,与对照组相比,接受PPRX-1701治疗后肿瘤组织中IDO1阳性细胞数量明显减少,IDO1转录水平也低了13倍。也就是说,PPRX-1701可能通过抑制IDO1来减缓小鼠GBM细胞的生长。
最后,研究团队还评估了PPRX-1701对肿瘤微环境中免疫细胞的影响,结果发现,经过PPRX-1701处理后,GL261细胞肿瘤微环境发生了明显的改变,如出现CD8+T细胞和CD103+树突状细胞数量增加,M2巨噬细胞数量减少的现象。这说明,PPRX-1701可以通过影响肿瘤免疫环境中的免疫细胞类型和数量,发挥抗肿瘤的作用。
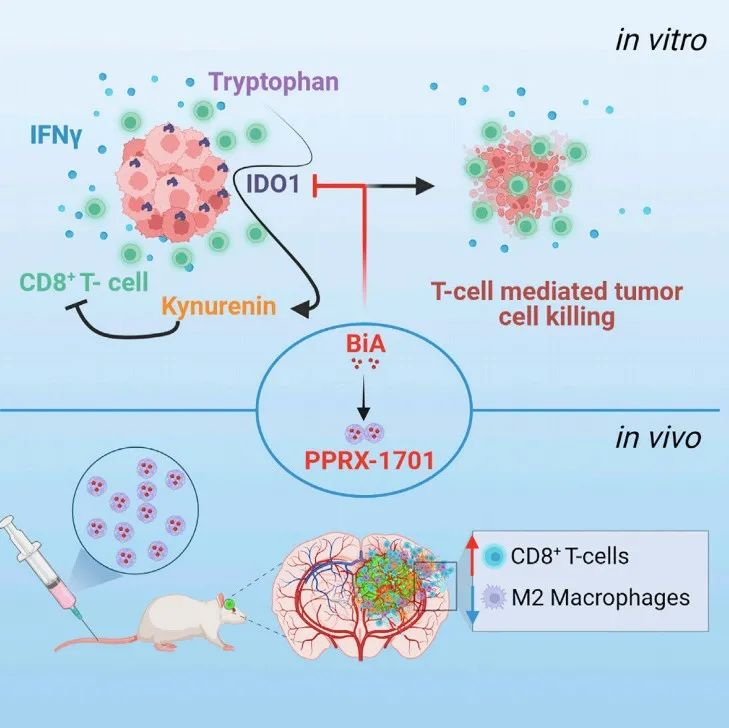
Figure5 研究过程
总之,本研究发现靛玉红衍生物BiA能通过抑制IDO1的表达来治疗GBM,静脉注射PPRX-1701,可延长GBM小鼠生存期,未来PPRX-1701若能走向临床,或许有望解决GBM生存率低这一难题。当然Sean E. Lawler也表示会继续研究这一中药衍生物,争取早日在GBM患者中展开临床试验。
参考文献:
[1]中国医学科学院血液学研究所, 中国医学科学院分院附属医院, 中国医学科学院基础医学研究所, 等. 靛玉红治疗慢性粒细胞白血病的临床与实验研究 [J] . 中华内科杂志,1979,18( 02 ): 83-88.
[2]褚建新, 储榆林. 靛玉红——中西医结合研究的一项硕果 [J] . 中华血液学杂志,2017,38 (06): 559-560.
[3]Williams SP, Nowicki MO, Liu F, Press R, Godlewski J, Abdel-Rasoul M, Kaur B, Fernandez SA, Chiocca EA, Lawler SE. Indirubins decrease glioma invasion by blocking migratory phenotypes in both the tumor and stromal endothelial cell compartments. Cancer Res. 2011 Aug 15;71(16):5374-80.
[4]Zdioruk M, Jimenez-Macias JL, Nowicki MO, Manz KE, Pennell KD, Koch MS, Finkelberg T, Wu B, Boucher P, Takeda Y, Li W, Piranlioglu R, Ling AL, Chiocca EA, Lawler SE. PPRX-1701, a nanoparticle formulation of 6'-bromoindirubin acetoxime, improves delivery and shows efficacy in preclinical GBM models. Cell Rep Med. 2023 Apr 11:101019.
*文章来源:奇点肿瘤探秘(Geekheal-Cancer)
*本文经北京奇点万象科技有限公司授权后转载至本网站,仅供医学专业人士阅读参考,请勿进行二次转载。

