众所周知,胰腺导管腺癌(PDAC)作为“癌王”,死亡率高,5年生存率低,最主要的原因之一是早期诊断较为困难,大部分患者确诊时已经处于晚期,只有10%-15%处于可切除或边缘性可切除阶段[1]。
影像学诊断在PDAC早诊中的准确性仍然不足[2],临床最常用的血液标志物CA19-9也作用有限,它缺乏敏感性,而且约10%的患者为Lewis抗原阴性血型结构,无法合成CA19-9[3,4],再加上胃癌、肝内胆管癌和结直肠癌,以及胰腺炎和梗阻性黄疸等多种肿瘤和非肿瘤性疾病均能够导致CA19-9升高,限制了CA19-9作为PDAC诊断标志物的特异性[5]。
为了改善PDAC早期诊断,大连医科大学张桂信教授和美国希望之城贝克曼研究所Ajay Goel教授的团队联合开展了一项研究。
他们发现,基于一组环状RNA(circRNA)的液体活检可以有效识别PDAC患者,区分早期和晚期阶段,诊断早期PDAC时的曲线下面积(AUC)超过0.8,与CA19-9结合使用,可提高至0.94,识别CA19-9阴性的PDAC患者的AUC也达到0.85。证实了这个基于环状RNA的液体活检工具在早期胰腺癌诊断中的效果,研究结果发表在Gastroenterology杂志上[6]。

环状RNA在多种实体癌中发挥核心作用,包括PDAC、胃癌、食管鳞癌、结直肠癌和肝癌。近年来,也有研究表明,环状RNA有作为癌症诊断和预后标志物的潜力[7,8],不过在PDAC的早期诊断中还没有同类研究。
本次研究中,研究团队首先使用两个独立的数据集,对PDAC患者的肿瘤组织和匹配对照的组织样本的环状RNA表达谱进行了分析。在125个表达增加和156个下降的环状RNA中,筛选出了10个重叠程度最高,表达显著增加的,基于它们构建的模型在两个数据集中能够有效区分肿瘤和邻近的正常组织。

筛选出的10个环状RNA
随后,在基于液体活检的测定,研究人员对此模型进行了进一步优化,将10个环状RNA缩减到5个,诊断能力优秀,AUC为0.83,特异性为0.74,敏感性为0.89,准确性为0.84。基于5个环状RNA的模型成功地将PDAC患者和非疾病对照组区分开来,其中87.3%(62/71)为真阳性,76.5%(26/34)为真阴性。
独立队列中,模型的区分能力
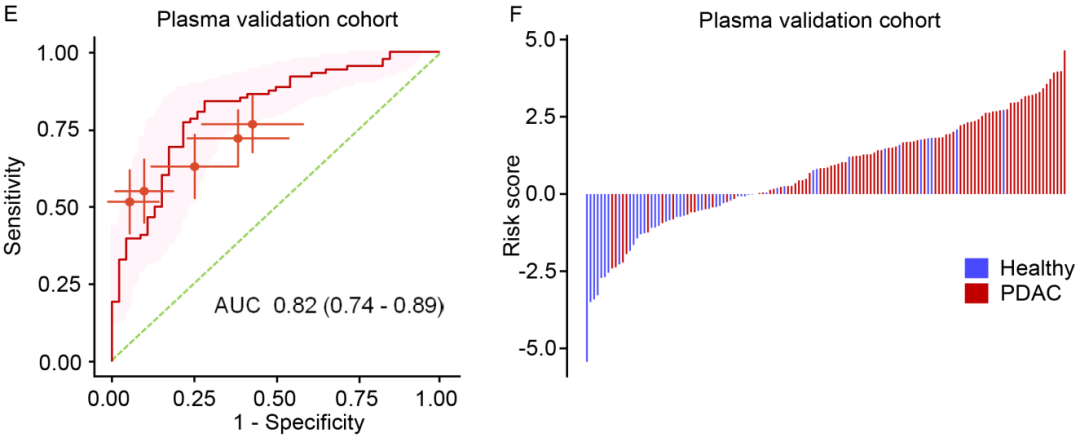
接下来,脱离数据集,研究人员在一个由88例PDAC患者和46例健康对照组成的独立队列中,对他们的模型进行了验证。
分析表明,模型的区分能力仍然是强大的,AUC为0.82,敏感性为0.84,特异性为0.71,85.1%(74/87)为真阳性,70.2%(33/47)为真阴性。
研究人员将PDAC患者按照早期(I/II期)和晚期(II/IV期)进行分组,在训练队列中,AUC为0.83,敏感性为0.90,特异性为0.74,在验证队列中,AUC为0.81,敏感性为0.83,特异性为0.72,准确性为0.78。这些结果说明了这个基于环状RNA的PDAC诊断模型在总体胰腺癌诊断和早期胰腺癌诊断中的良好表现。
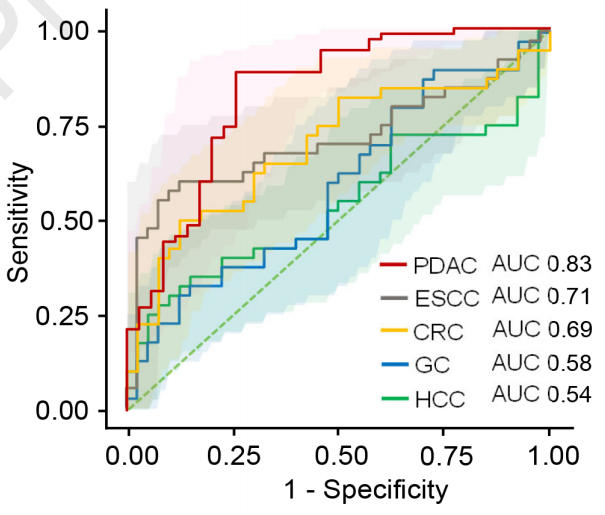
前面我们提到过,CA19-9用于胰腺癌诊断的限制之一就是特异性不足,多种胃肠道癌和非癌疾病都可以导致CA19-9水平升高,环状RNA诊断模型是否也会存在这个问题呢?
为了验证这一点,研究人员在食管鳞癌、结直肠癌、胃癌、肝癌患者和各自的健康对照中同样使用环状RNA模型进行了诊断测试,和PDAC的AUC 0.83相比,以上几种癌症的AUC值都显著降低,分别为0.71、0.69、0.58和0.54。
几种癌症的AUC比较
考虑到CA19-9是最常用的血清肿瘤标志物,研究人员尝试将其与环状RNA模型相结合,他们检测了验证队列PDAC患者的血浆CA19-9水平,CA19-9诊断PDAC的AUC为0.87,敏感性为0.77,特异性为0.89,当二者结合时,诊断能力显著提高,AUC、敏感性和特异性分别提高到0.95、0.82和0.96,诊断早期PDAC的AUC、敏感性和特异性也高达0.94、0.79和0.96,准确性为0.86。
在验证队列中,有20例PDAC患者CA19-9水平低于37 U/mL,属于阴性结果。在纳入这20例患者和41例健康对照的队列中,环状RNA模型的AUC为0.85,敏感性为0.85,特异性为0.76,仍然具有较强的诊断能力。
这些数据表明,基于环状RNA的液体活检具有作为无创PDAC早期诊断的强大潜力。未来,需要在更大型的临床队列中验证这一诊断模型的能力。
参考文献:
[1] Versteijne E, van Dam J L, Suker M, et al. Neoadjuvant chemoradiotherapy versus upfront surgery for resectable and borderline resectable pancreatic cancer: long-term results of the Dutch randomized PREOPANC trial[J]. Journal of Clinical Oncology, 2022, 40(11): 1220-1230.
[2] Toft J, Hadden W J, Laurence J M, et al. Imaging modalities in the diagnosis of pancreatic adenocarcinoma: A systematic review and meta-analysis of sensitivity, specificity and diagnostic accuracy[J]. European journal of radiology, 2017, 92: 17-23.
[3] Parra-Robert M, Santos V M, Canis S M, et al. Relationship between CA 19.9 and the Lewis phenotype: options to improve diagnostic efficiency[J]. Anticancer research, 2018, 38(10): 5883-5888.
[4] Ballehaninna U K, Chamberlain R S. The clinical utility of serum CA 19-9 in the diagnosis, prognosis and management of pancreatic adenocarcinoma: An evidence based appraisal[J]. Journal of gastrointestinal oncology, 2012, 3(2): 105.
[5] Luo G, Jin K, Deng S, et al. Roles of CA19-9 in pancreatic cancer: Biomarker, predictor and promoter[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2021, 1875(2): 188409.
[6] Xu C, Jun E, Okugawa Y, et al. A circulating panel of circRNA biomarkers for the noninvasive and early detection of pancreatic ductal adenocarcinoma[J]. Gastroenterology, 2023.
[7] Li S, Han L. Circular RNAs as promising biomarkers in cancer: detection, function, and beyond[J]. Genome medicine, 2019, 11: 1-3.
[8] Roy S, Kanda M, Nomura S, et al. Diagnostic efficacy of circular RNAs as noninvasive, liquid biopsy biomarkers for early detection of gastric cancer[J]. Molecular Cancer, 2022, 21(1): 1-12.
*文章来源:奇点肿瘤探秘(Geekheal-Cancer)
*本文经北京奇点万象科技有限公司授权后转载至本网站,仅供医学专业人士阅读参考,请勿进行二次转载。

